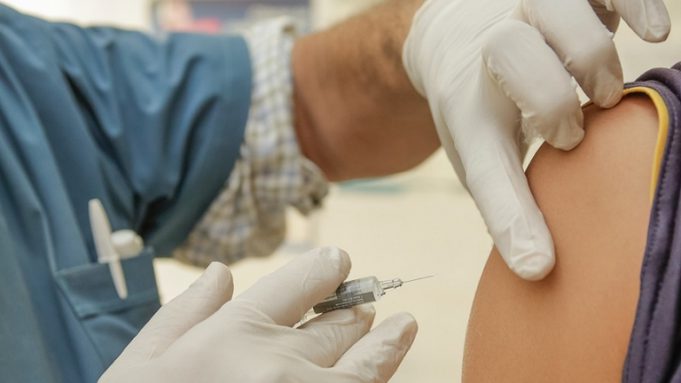
Il vaccino contro il Covid-19 sviluppato dalla compagnia statunitense Moderna ha un’efficacia del 94,5%. Lo indicano i dati preliminari pubblicati oggi dall’azienda sulla scia di quelli della scorsa settimana di Pfizer, che in collaborazione con la tedesca BioNTech sta sviluppando un vaccino che ha mostrato un’efficacia del 90 per cento sui volontari che si sono sottoposti alla sperimentazione di Fase 3.
Quanto a Moderna, la prima analisi preliminare ha visto 95 partecipanti con casi confermati di Covid-19. L’azienda intende ora presentare una richiesta d’autorizzazione all’uso per emergenza alla Food and Drug Administration (Fda) statunitense nelle prossime settimane. L’autorizzazione, fa sapere la società in un comunicato, si baserà sull’analisi finale di 151 casi e su un follow-up mediano di oltre due mesi.
“Questo è un momento cruciale per lo sviluppo del nostro candidato al vaccino contro il Covid-19. Dall’inizio di gennaio, abbiamo inseguito questo virus con l’intento di proteggere il maggior numero possibile di persone in tutto il mondo. Da sempre sappiamo che ogni giorno è importante. Questa analisi preliminare positiva del nostro studio di Fase 3 ci ha dato la prima conferma clinica che il nostro vaccino può prevenire il Covid-19, incluse le forme gravi”, ha dichiarato Stephane Bancel, amministratore delegato di Moderna.
L’azienda annuncia inoltre una durata di conservazione più lunga per il suo candidato vaccino mRNA-1273 contro il COVID-19 a temperature di refrigerazione. Si prevede, riferisce ancora il comunicato, che il candidato vaccino rimanga stabile a temperature standard di refrigerazione tra 2 e 8 gradi centigradi per 30 giorni, rispetto alla precedente stima di sette giorni; condizioni di trasporto e conservazione a lungo termine a temperature standard del congelatore di -20 gradi centigradi per 6 mesi; mRNA-1273 è distribuibile utilizzando l’infrastruttura di somministrazione e stoccaggio del vaccino ampiamente disponibile; non è richiesta alcuna diluizione prima della vaccinazione.
“Riteniamo che i nostri investimenti nella tecnologia di distribuzione dell’mRNA e nello sviluppo del processo di produzione ci permetteranno di conservare e spedire il nostro candidato vaccino contro il COVID-19 a temperature che si trovano comunemente nei congelatori e nei frigoriferi farmaceutici prontamente disponibili”, ha dichiarato Juan Andres, chief technical operations and quality officer di Moderna. “Siamo lieti di presentare queste condizioni di stabilità estesa per l’mRNA-1273 alle autorità per l’approvazione. La possibilità di conservare il nostro vaccino fino a 6 mesi a -20 gradi centigradi, inclusi fino a 30 giorni in condizioni normali di frigorifero dopo lo scongelamento, è uno sviluppo importante e consentirebbe una distribuzione più semplice e una maggiore flessibilità per facilitare una vaccinazione su più ampia scala negli Stati Uniti e in altre parti del mondo”.
© Agenzia Nova – Riproduzione riservata